Non vi è dubbio che nuovi, non invasivi, ben tollerati metodi di cura dei tumori si sono affiancati in questi ultimi anni alla convenzionale terapia chirurgica, chemioterapica e radiante. Effetti collaterali pesanti, causati dai farmaci citotossici a dosi elevate, da chirurgia demolitiva e da radioterapia a dosi massimali possono essere sicuramente limitati da innovazioni terapeutiche affermatesi negli ultimi anni.
Nel bilancio terapeutico di un malato di tumore bisogna considerare la regressione della malattia, gli effetti collaterali delle terapie praticate, la durata di vita del paziente, ma anche la qualità di vita che le nostre cure tendono ad assicurare al malato neoplastico. Questo è tanto più vero quando andiamo a trattare un soggetto in età avanzata (in questo caso gli effetti collaterali dei farmaci sono spesso particolarmente temibili) o quando dobbiamo trattare patologie scarsamente sensibili alla terapia farmacologica disponibile.
Il concetto base che ci deve guidare è che, se il tumore non è eradicabile o se le possibilità di regressione sono particolarmente difficili, è certamente più vantaggioso puntare ad una stabilizzazione a lungo termine della malattia o ad una sua parziale regressione, conservando per quanto possibile le migliori condizioni di vita dell’ammalato.
Quando la malattia non può essere debellata, è molto più realistico cercare di ottenere una cronicizzazione della patologia come avviene in altre situazioni cliniche (ad esempio diabete, ipertensione, malattie reumatiche, ecc.). Ipertermia, cioè la cura dei tumori utilizzando il calore, e Immunomodulazione, ossia l’uso di sostanze ad azione stimolante immunitaria o regolatrice della risposta immunologica, sono provvedimenti terapeutici associabili, utilizzabili per lunghi periodi di tempo e, cosa più importante, senza effetti collaterali.
CONSIDERAZIONI GENERALI
Negli anni Sessanta l’oncologia tradizionale ha visto avvenire cambiamenti che hanno dato la speranza di una soluzione definitiva al problema dei tumori. Nei dieci anni precedenti, numerosi studi avevano evidenziato la connessione esistente tra stato immunitario del paziente e sviluppo della malattia neoplastica. Queste considerazioni avevano portato a sperare di poter controllare o inibire la crescita tumorale mediante stimolazione del Sistema Immunitario.
Negli anni attorno al 1960 in Francia, Georges Mathè aveva dimostrato come trattando alcuni tumori con agenti immunostimolanti, ad esempio il BCG (bacillo di Calmette e Guérin, una versione attenuata del batterio che provoca la tubercolosi bovina), essi potevano essere controllati più a lungo. Aveva infatti constatato che, instillando direttamente il BCG nei noduli solidi di Melanoma, alcune delle lesioni regredivano e poteva esserci un beneficio sull’evoluzione generale della malattia. Analogamente, i tumori della vescica trattati con istillazioni endovescicali di BCG, in alcuni casi guarivano. In pratica l’associazione di ablazione o asportazione endoscopica delle neoplasie vescicali con trattamento a base di sostanze immunomodulanti poteva portare alla guarigione o indurre lunghe remissioni di malattia in pazienti portatori di tumori vescicali. Contemporaneamente Peter Reizenstein, Ematologo di Stoccolma, aveva notato come la remissione ematologica e clinica nei bambini affetti la Leucemia Linfatica Acuta veniva prolungata in maniera statisticamente significativa quando alla chemioterapia tradizionale si associava un trattamento di mantenimento con BCG.
Sokal, negli Stati Uniti, trattava con l’associazione chemioterapici-BCG i Linfomi e soprattutto i Linfomi di Hodgkin, ottenendo risultati che erano superori al solo trattamento chemioterapico. Questo approccio innovativo di tipo biologico al trattamento dei tumori, non ebbe poi gran seguito per l’affermazione a partire dagli anni Settanta-Ottanta fino ad oggi di una concezione più aggressiva nella terapia antineoplastica. In pratica, facendo seguito ai successi terapeutici ottenuti con schemi di polichemioterapia nelle malattie ematologiche, soprattutto nelle leucemie acute e nei linfomi, si è pensato che trattamenti dello stesso tipo potessero essere utili nella stragrande maggioranza delle malattie oncologiche, che sono costituite da tumori solidi di tipo epiteliale, ad esempio i tumori del polmone, dello stomaco, del pancreas, dell’ovaio, della mammella, etc.
Questi concetti di trattamento chemioterapico per i tumori hanno finito per porre in secondo piano lo sviluppo di terapie di tipo biologico meno aggressive, di efficacia immediata meno evidente e, si pensava, con potenziali di sviluppo inferiori.
In realtà ci si è dovuti rendere conto che, dopo quarant’anni di utilizzo sistematico della chemioterapia nei tumori solidi, i risultati non rispecchiano le aspettative. La mortalità per tumori solidi in Italia e nel mondo tende a diminuire molto lentamente e prevalentemente grazie al diffondersi di una mentalità preventiva che consente, attraverso le molteplici indagini di screening attualmente disponibili (mammografia, colonscopia, ecografia trans-rettale, dosaggio PSA, PAP-test, ecc.) l’individuazione e il trattamento di alcuni tumori in fase estremamente precoce, quando cioè un intervento chirurgico ha buone possibilità di essere radicale.
Andando alla radice dell’atteggiamento corrente per quanto riguarda la terapia oncologica, dobbiamo rilevare che la metodologia clinica attualmente in auge deriva dal concetto teorico che i chemioterapici ad azione citotossica possono indurre la morte delle cellule maligne e quindi la guarigione della malattia. Tale discorso si é rivelato corretto per quanto riguarda alcune malattie ematologiche e alcuni tipi di tumore del bambino. Nei linfomi e nelle leucemie ci troviamo di fronte a tessuti (i tessuti emolinfopoietici) particolarmente sensibili all’azione dei chemioterapici: il tessuto tumorale è a stretto contatto con il sangue che circola nei capillari e nel midollo osseo, nella milza e anche nei linfonodi, quindi i farmaci somministrati, diluiti nella corrente sanguigna, vengono distribuiti in maniera abbastanza omogenea, raggiungendo concentrazioni sufficientemente elevate a livello delle cellule bersaglio.
Nei tumori solidi, dove la vascolarizzazione è atipica, non avviene la facile distribuzione delle sostanze presenti nel circolo sanguigno.
Gli studi effettuati da Harry Le Veen hanno dimostrato come la neoangiogenesi tumorale, cioè la nuova formazione di vasi sanguigni da parte di una massa neoplastica in accrescimento, tende a diventare autonoma rispetto alla circolazione dell’organismo e a svilupparsi in maniera disordinata. Il tumore infatti non è un tessuto che si sviluppa in maniera coordinata ma ha, al contrario, uno sviluppo incontrollato, afinalistico e la rete vascolare del tumore, più o meno sviluppata, presenta sempre un’elevata resistenza al flusso. Ne consegue che i farmaci, sia introdotti per via venosa sia assorbiti attraverso la parete intestinale, giungono in corrispondenza della cellula tumorale in concentrazioni (quindi in quantità) inferiori a quelle che si raggiungono nei tessuti sani, per cui il gradiente terapeutico, cioè la differenza di concentrazione tra il tessuto sano e quello patologico, è sfavorevole alle cellule tumorali, che sono invece quelle che avrebbero maggiore necessità di essere colpite.
Nel caso dei tumori le mutazioni avvengono in maniera incontrollata e il Sistema Immunitario non è in grado di reprimerle. Comunque, le cellule mutate diventano solitamente meno sensibili ai trattamenti effettuati e soprattutto acquisiscono delle particolari caratteristiche che le rendono resistenti a quasi tutte le sostanze utilizzate per la terapia: questo fenomeno si chiama multidrug resistance ed è regolato a livello genico. In pratica, le cellule tendono a riconoscere il farmaco come un fattore tossico e ad espellerlo dall’interno della cellula stessa. Inoltre, le cellule tumorali d’origine e quelle che migrano a distanza a formare metastasi si sviluppano in un ambiente con una saturazione di ossigeno insoddisfacente, per le ragioni anatomiche e vascolari alle
quali abbiamo già accennato.
Questo fenomeno, unitamente all’insufficienza vascolare, limita pesantemente la risposta delle cellule neoplastiche a farmaci e radiazioni. Essendo questo il panorama generale della chemioterapia e radioterapia oncologiche, ne consegue la necessità di rielaborare concetti e schemi terapeutici, rivalutando gli approcci metodologici che comprendono le cosiddette terapie biologiche: stimolazione immunitaria, ipertermia, modificazioni metaboliche.
Per questa ragione negli ultimi anni sono stati elaborati schemi terapeutici integrativi o complementari alle classiche chemio e/o radioterapie, con lo scopo di migliorare i risultati terapeutici, ottenere per il paziente condizioni di vita soddisfacenti e salvaguardare, nel limite del possibile, l’integrità fisica del malato oncologico.
Nelle moderne società industriali di tipo occidentale, uno dei fenomeni caratteristici è la progressiva espansione della patologia neoplastica. I fattori causali finora presi in considerazione sono costituiti soprattutto dall’inquinamento ambientale, dal fumo di sigaretta e dalla moderna alimentazione. Anche il dato positivo dell’allungamento della vita media contribuisce in maniera determinante all’aumentata frequenza di alcuni tipi di tumore, caratteristici dell’età avanzata: la reattività immunologica di un soggetto tende spontaneamente a diminuire con il passare degli anni, a partire della quarta decade di vita.
Un ridotto controllo immunitario sulla crescita tumorale, causato dall’età, dall’inquinamento, da un’alimentazione sbilanciata o anche da fattori genetici, contribuisce in maniera determinante ad indurre l’incremento dell’incidenza delle neoplasie che si verifica dalla sesta decade di vita in poi. Iperalimentazione, squilibri o carenze alimentari specifiche possono favorire particolari patologie tumorali. Dati incontrovertibili in questa direzione giungono confrontando la dieta occidentale e la dieta di tipo orientale, in rapporto allo sviluppo dei tumori, ad incidenza nettamente inferiore nelle popolazioni che si alimentano con un apporto limitato di grassi e proteine animali. L’alimentazione condiziona pesantemente, in positivo e in negativo, la reattività immunitaria sia nell’animale che nell’uomo. Per tale motivo il comportamento alimentare è da considerare un problema centrale per lo sviluppo dei tumori, oltre che per la loro prevenzione. Incongrui atteggiamenti dietetici sono determinanti anche nel favorire infezioni, malattie degenerative ed autoimmuni, direttamente o attraverso alterazione dell’equilibrio immunitario.
Alimentarsi correttamente è quindi essenziale per il mantenimento nel tempo di uno stato clinico di benessere. In assenza di dati epidemiologici di assoluta certezza, autorità ed enti di numerosi stati (soprattutto Stati Uniti e Svezia) hanno preferito la via del coinvolgimento indiretto del pubblico attraverso l’informazione ai medici, l’intervento massiccio in senso preventivo di orientamento delle abitudini alimentari della popolazione. Ne sono scaturite “raccomandazioni” probabilmente molto più prudenti di quanto le reali dimensioni del problema avrebbero dovuto suggerire.
CANCRO e PREVENZIONE
La prevenzione è il mezzo più efficiente per ridurre o eliminare i fattori che favoriscono l’insorgere della malattia. Si distinguono tre momenti della prevenzione:
- Prevenzione primaria, il cui scopo è ridurre l’incidenza del Cancro evitando i fattori di rischio noti e aumentando i mezzi di difesa
- Prevenzione secondaria, il cui scopo è individuare il tumore in uno stadio precoce in modo da poter intervenire tempestivamente con i metodi di cura, al fine di ridurre il tasso di mortalità
- Prevenzione terziaria, il cui scopo è evitare la comparsa di metastasi e di recidive mediante l’applicazione di terapie
Le strategie della prevenzione primaria sono riassunte nel Decalogo Europeo contro il Cancro:
1. Smettere di fumare, in quanto il fumo è un fattore importante del Cancro al Polmone
2. Moderare il consumo di alcolici, il cui abuso provoca danni alla bocca, al primo tratto del tubo digerente e al fegato
3. Bonificare gli ambienti di vita e di lavoro in cui sono presenti sostanze cancerogene come amianto, radon, benzene
4. Esporsi al sole con cautela e proteggersi con creme, in quanto i raggi solari sono responsabili del Melanoma
5. Fare un’alimentazione equilibrata e sana favorendo l’uso di verdure, frutta, legumi, cibi integrali
6. Moderare i cibi grassi e le carni rosse
7. Non aumentare troppo di peso
8. Fare attività fisica
9. Rivolgersi al medico in caso di sintomi persistenti (tosse, raucedine, cambiamento delle abitudini intestinali, perdita di peso, febbre), anomala perdita di sangue con le feci o le urine, modificazione dell’aspetto di un neo, comparsa di un nodulo
10. Per le donne, fare il PAP test ogni anno e fare sovente l’autopalpazione del seno
Fondamentale è comunque mantenere attivo il Sistema Immunitario mediante una dieta adeguata con il giusto apporto di minerali e vitamine, supportando le fasi di stress fisico e psichico con l’apporto calorico al fine di non andare in debito di energia endocellulare, cercando di moderare i fattori stressanti (superlavoro, ansia, paura), supportando l’attività immunitaria con prodotti non tossici e di derivazione naturale in particolare nei mesi di cambiamento stagionale, durante la convalescenza, nel corso delle terapie con antibiotici.
CANCRO e CARCINOGENESI
La carcinogenesi è il processo che porta alla trasformazione neoplastica e allo sviluppo incontrollato delle cellule tumorali. Si distinguono tre fasi:
- Fase di induzione: le cellule subiscono una mutazione o un’alterazione irreversibile del DNA per azione di un agente iniziante, che può essere di tipo biologico o fisico o chimico o psichico. Queste cellule possono rimanere silenti a vita se non si passa alla fase successiva
- Fase di promozione: le cellule trasformate e sottoposte a determinati stimoli iniziano a proliferare. Gli agenti promuoventi agiscono in modo reversibile sulle cellule che hanno subito l’induzione, modificandone il comportamento
- Fase di progressione: queste stesse cellule assumono i caratteri maligni, continuando a moltiplicarsi e formando aggregati neoplastici

Appare ovvio che un Sistema Immunitario attivo può intervenire in ciascuna di queste fasi, eliminando le cellule alterate e ostacolandone la progressione. Nel corso della vita ognuno di noi produce cellule maligne che vengono immediatamente riconosciute e uccise dal Sistema Immunitario, se qualcuna sfugge a questo meccanismo di controllo può rimanere nascosta in fase latente anche per anni, per poi progredire e sviluppare un Cancro nel momento in cui il nostro sistema di difesa è poco attento.
Quando il tumore è ormai presente, il Sistema Immunitario può tenerlo sotto controllo instaurando un vero e proprio equilibrio, ma se le cellule continuano a proliferare sfuggendo all’intercettazione immunitaria, allora il Tumore cresce fino a raggiungere dimensioni e velocità di diffusione tali per cui il Sistema Immunitario non è più in grado di opporre resistenza.
IMMUNOTERAPIA
L’Immunoterapia, anche detta “Terapia Biologica”, è un metodo di cura che non agisce direttamente sulla malattia o sulle sue cause, ad esempio virus e batteri, ma attraverso l’attivazione e il potenziamento del Sistema Immunitario che viene indotto a reagire ed eliminare gli elementi estranei.
L’Immunoterapia è anche un metodo di prevenzione contro l’insorgenza delle infezioni batteriche e virali, grazie al mantenimento di un sistema di difesa attivo. Essa è quindi di fondamentale importanza per prevenire e per combattere le malattie, utilizzando farmaci privi di tossicità e che supportano le nostre difese senza provocare ulteriori danni all’organismo.
Oltre che contro gli agenti infettanti, l’Immunoterapia ha un ruolo essenziale nel combattere il Cancro, che più facilmente si sviluppa, cresce e metastatizza se il Sistema Immunitario è debole e incapace di contrapporsi allo sviluppo della malattia: se il Sistema Immunitario è in grado di svolgere pienamente la sua funzione di sorveglianza, il Cancro ha senza alcun dubbio minori possibilità di avere il sopravvento.
L’uso dell’Immunoterapia contro il Cancro è nato a seguito dell’osservazione che pazienti affetti da questa patologia, guarivano spontaneamente senza intervenire con nessuna cura.
I principali metodi di Immunoterapia del Cancro sono la vaccinazione, l’immunoterapia aspecifica, l’Immunoterapia attiva, l’Immunoterapia passiva.
La vaccinazione si basa sull’uso di cellule tumorali prelevate dal paziente e opportunamente trattate prima del re-inoculo, in modo da renderle più immunogeniche. L’Immunoterapia aspecifica consiste nell’iniettare sostanze che sono in grado di stimolare e attivare in modo non specifico il Sistema Immunitario, come ad esempio i Lipopolisaccaridi, inducendolo a reagire contro le cellule neoplastiche considerate elementi estranei all’organismo. L’Immunoterapia attiva utilizza fattori (citochine) o cellule del Sistema Immunitario. L’Immunoterapia passiva si basa sull’uso di anticorpi preparati in laboratorio (anticorpi monoclonali), che si legano a specifici recettori di alcuni tipi di cellule neoplastiche.
Secondo la teoria immunoediting formulata da Dunn nel 2002, il Sistema Immunitario ha tre possibilità di intervenire contro il Cancro: reagisce e lo distrugge; crea uno stato di equilibrio con la malattia per cui non distrugge il Cancro ma ne controlla lo sviluppo; non riconosce le cellule tumorali che quindi crescono con sempre maggiore aggressività.
L’Immunoterapia è di fondamentale importanza per prevenire e per combattere le malattie mediante l’uso di farmaci privi di tossicità, che supportano le nostre difese senza provocare danno ai metabolismi. Negli ultimi anni essa è inoltre ritenuta fondamentale nella lotta contro il Cancro in particolar modo se associata alla chemioterapia, di cui limita i ben noti effetti tossici.
Immunoterapia Biologica di Giuseppe Zora
L’Immunoterapia Biologica (ITB), messa a punto dal dott. Giuseppe Zora, è applicabile in ogni forma tumorale, in quanto la stimolazione e la conseguente attivazione del Sistema Immunitario avviene a qualunque livello di organo o di apparato del nostro organismo.
L’interessamento del Sistema Immunitario da parte della ITB è globale; infatti vengono coinvolti sia il Sistema Immunitario cellulare che quello umorale (anticorpi, complemento, etc) per ottenere una azione sinergica contro la malattia senza alcuna barriera sia fisiologica (vedi barriera ematoencefalica) che patologica (creata dallo stesso tumore), vedi sito Fondazione Raphael: www.fondazioneraphael.ch
La ITB è quindi applicabile nelle forme neoplastiche maligne di:
CERVELLO
APPARATO RESPIRATORIO: Cavità nasali, Laringe, Trachea, Bronchi, Polmoni, Pleure
APPARATO DIGERENTE: Bocca, Faringe, Esofago, Stomaco, Intestino tenue, Intestino crasso
APPARATO ESCRETORE: Reni, Ureteri, Vescica, Uretra
APPARATO RIPRODUTTORE: Utero, Ovaie, Salpingi, Vagina (per la donna) e Prostata, Testicoli, Pene (per l’uomo)
FEGATO, VIE BILIARI, COLECISTI.
PANCREAS, SURRENI
TESTA e COLLO
APPARATO SCHELETRICO (ossa e articolazioni)
CUTE (compresi i Melanomi)
SISTEMA LINFATICO (Linfomi)
LEUCEMIE e MIELOMI
La ITB non ha effetti collaterali.
LaITB può essere utilizzata da sola o insieme ad altre terapie, comprese la chemioterapia, la radioterapia, la ormonoterapia, gli Anticorpi monoclonali e le nuove Terapie antirecettoriali.
La ITB può essere utilizzata insieme a Terapie naturali, omeopatiche, ayurvediche.
Per quanto riguarda le vie di somministrazione sono diverse e variano in base allo stato e alla localizzazione della malattia neoplastica:
Per via intramuscolare
Per via sottocutanea
Per via orale
Per aerosol
Intraperitoneale (dopo paracentesi)
Direttamente attorno alle lesioni neoplastiche visibili
La ITB viene regolata con adeguata posologia che tiene conto dell’età del Paziente, delle condizioni generali, delle condizioni metaboliche, della sintomatologia e delle terapie in atto.
La ITB viene effettuata con un primo Ciclo Test della durata minima di 30 giorni, fino ad un massimo di 90 giorni e si monitorizzano parametri ematologici da effettuare prima dell’inizio della terapia con ITB e al termine della stessa.
In base ai risultati clinici ed ematologici ottenuti si prosegue personalizzando la ITB per ogni singolo Paziente:
- ogni Paziente ha il suo Sistema Immunitario
- ogni Paziente avrà la sua ITB
La ITB è utilizzata in diverse patologie autoimmuni allo scopo di regolare il Sistema Immunitario, ovvero per dargli una nuova informazione.
La ITB è utilizzata in tutte le forme infettive, sia virali che batteriche.
In ogni caso la posologia della ITB viene personalizzata.
La ITB è praticabile anche da parte di Bambini e Ragazzi.
Antigeni e Immunogeni
Si definisce antigene qualsiasi elemento estraneo all’organismo, capace di indurre una risposta immunospecifica con la generazione di una popolazione di Linfociti B reattivi e conseguente produzione di anticorpi specifici.
La completa risposta del Sistema Immunitario con attivazione sia della via cellulo-mediata sia della via tumorale, avviene solo se l’antigene possiede il carattere di immunogenicità, ovvero deve possedere due requisiti essenziali: provenire da una specie diversa o da un soggetto diverso della stessa specie; avere un alto peso molecolare. Infatti più grande è la molecola, maggiore è la sua capacità antigenica. Molecole di peso inferiore a 10KD non inducono risposta immunogenica.
Affinché si attivi l’immunogenicità, l’antigene oltre ad essere una macromolecola non inerte e ad elevato peso molecolare, deve presentare siti o regioni tali da poter essere captato dal Sistema Immunitario. Questi siti vengono definiti “determinanti antigenici o epitopi” e le loro caratteristiche molecolari sono: accessibilità, idrofilia, mobilità, anfipaticità.
Lipopolisaccaridi (LPS)
Il termine “Lipopolisaccaride” viene usato per meglio definire dal punto di vista chimico i componenti della parete cellulare esterna dei batteri gram-negativi, ovvero le endotossine, la cui storia nella medicina ha antiche origini: gli Egiziani, i Romani, i Persiani, utilizzavano a scopo terapeutico la febbre provocata dalle infezioni batteriche. Nel Medioevo e poi nel 1800, la “febbre-terapia” è stata usata per combattere le più svariate malattie come l’artrite, la depressione maniacale, la sifilide, le malattie della pelle, l’Herpes zoster. Nel 1876 Burdon e Sanderson chiamarono “pirogeni” gli elementi infettanti, causa della febbre. Nel 1892 Pfeiffer coniò il termine “endotossine batteriche”.
I Lipopolisaccaridi (LPS) sono molecole altamente complesse e possiedono le caratteristiche dell’immunogenicità, tanto da essere definiti il più potente immunogeno naturale: estraneità di specie, elevato peso molecolare, complessità chimica della struttura. I LPS si ottengono dalla membrana dei batteri gram negativi con metodiche di estrazione e di purificazione enzimatica, per solubilizzazione con detergenti, acidi, composti organici, per dialisi, per ultrafiltrazione.
I LPS sono termostabili e sensibili agli ossidanti come il superossido, il perossido e l’ipoclorito.
Caratteristiche chimiche
La maggior parte delle informazioni riguardanti la struttura chimica dei LPS sono state ottenute dallo studio della specie Escherichia coli e della Salmonella typhi.
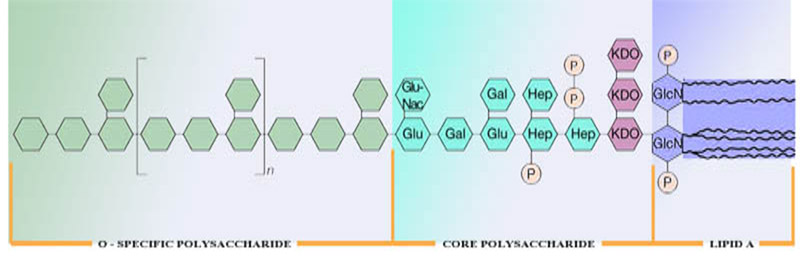
I LPS hanno peso molecolare superiore a 10kD, differiscono per struttura sia nei batteri dello stesso ceppo sia nei batteri di ceppi diversi. La molecola è composta da tre differenti strutture:
Lipide A
E’ la frazione idrofobica che consente alla molecola di rimanere ancorata alla parete batterica. Il Lipide A è un dimero fosforilato di N-acetilglucosamina (NAG), unito ad acidi grassi saturi con legame beta1,6. Alcuni di questi acidi grassi sono esterificati 3-OH e differiscono in ogni ceppo batterico.
La struttura del Lipide A è altamente conservata tra i batteri gram negativi.
Il Lipide A è a sua volta legato a una frazione proteica, denominata endotossina, a cui è imputata la tossicità.
Core o Polisaccaride R
E’ formato da una corta catena di zuccheri presenti in modo ripetitivo che determinano il carattere antigenico della molecola. A sua volta, la catena polisaccaridica è legata a ripetute unità di un particolare e inusuale eteroligosaccaride acido, l’acido 2keto,3-desossioctonico (KDO). Quest’ultimo, essendo invariabilmente presente in tutti i LPS, è considerato elemento caratteristico della struttura molecolare.
Il Core ha funzione antigenica e varia da ceppo a ceppo.
Polisaccaride O
E’ la frazione molecolare formata da ripetute unità di zuccheri con funzione anch’essa di antigene.
Lipopolisaccaridi e Sistema Immunitario
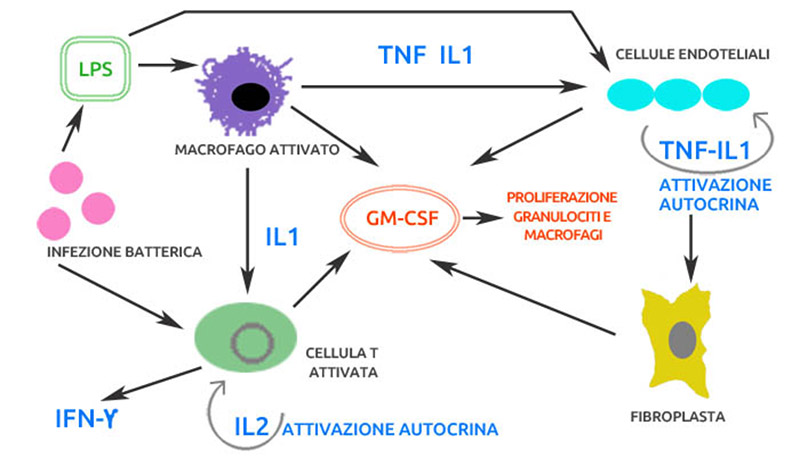
I LPS ottenuti dalla lisi della cellula batterica, si legano nel plasma dell’individuo ospite con proteine specifiche, note come LPS-Binding Proteins (LBP). Questo complesso macromolecolare LPS-LBP interagisce con i recettori CD14 dei Monociti-Macrofagi, innescando la risposta immunitaria.
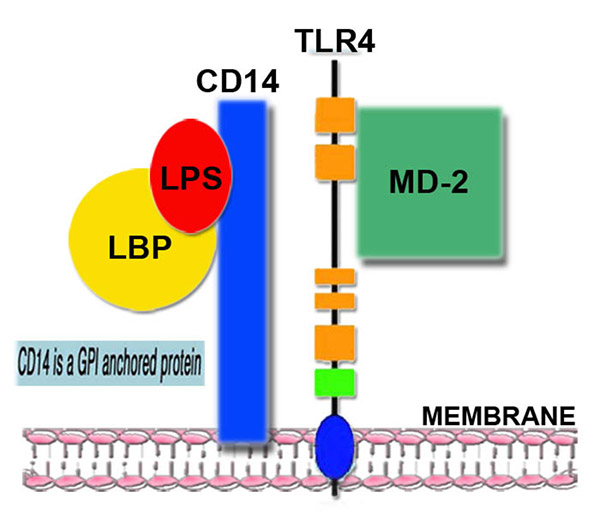
Di questi recettori attualmente si conoscono 13 unità distinte e vengono genericamente indicati col nome di “Toll-receptors” (TLR). I TLR mediano segnali di attivazione aventi come bersaglio finale i geni, che codificano per proteine recettoriali di presentazione dell’antigene e per citochine regolatrici della Risposta Immune .
In particolare, i LPS interagiscono con TLR4 per la presenza del cofattore MD2.
I TLR sono presenti anche sulla superficie delle cellule dendritiche, agiscono come vere e proprie sentinelle preposte per avvertire immediatamente il Sistema Immunitario della presenza di elementi estranei, attivandolo e indirizzandone il tipo di risposta.
Essi sono quindi la prima linea di difesa.
La stimolazione dei TLR da parte dei LPS si traduce in segnali, che inducono nei Monociti-Macrofagi una serie di risposte immunitarie:
• produzione di ossigeno nascente
• attivazione della cascata del Complemento
• attivazione della via alternativa del Complemento
• produzione di Citochine (IL1, IL6, IL12, TNFalfa, PAF)
• attivazione di IFN
• attivazione delle Cellule NK
I LPS hanno effetti diretti sui Monociti-Macrofagi e sui Linfociti B. Nei Macrofagi inducono l’attivazione e quindi il potenziamento della fagocitosi e della chemiotassi, la citotossicità con produzione di enzimi lisosomiali, la produzione di Citochine. Nei Linfociti B gli LPS agiscono inducendo la proliferazione clonale, la differenziazione in Plasmacellule mature, la produzione di Anticorpi: